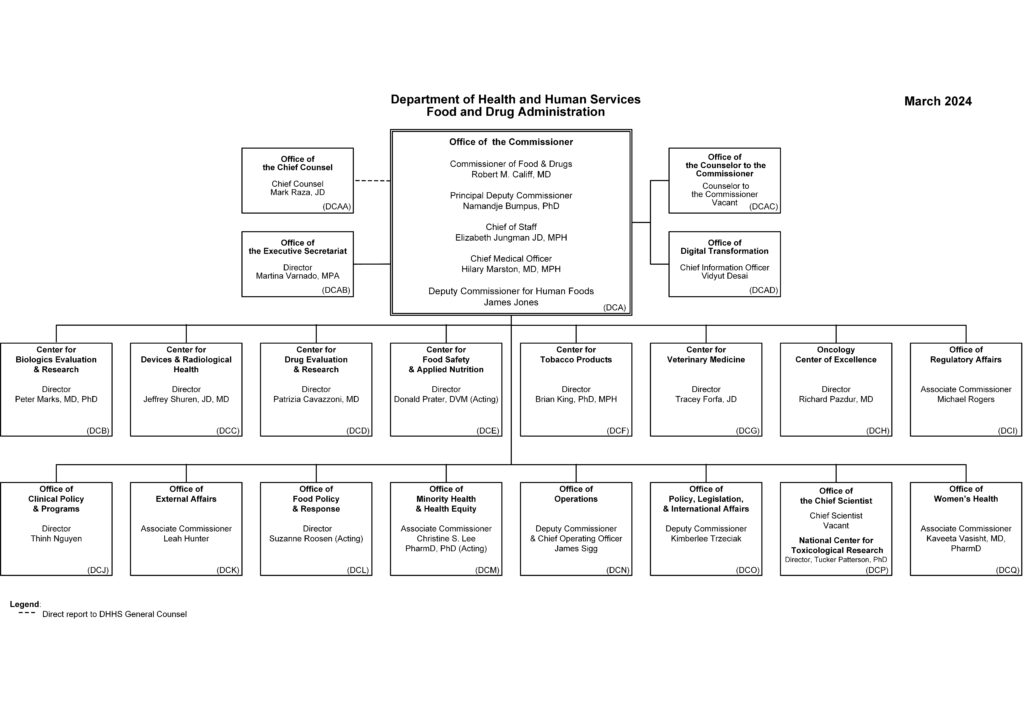
FDAの最新版組織図(CBER、CDER)
2024年3月時点のFDA組織図は以下のとおりです。最新版はFDAホームページからご確認いただけます。
医薬品の承認審査はCDER、バイオ医薬品の承認審査はCBERで行われます。それぞれの組織と役割は下で説明しています。
CDER(Center for Drug Evaluation and Research)
CDERとは、Center for Drug Evaluation and Researchの略称で、医薬品の安全性、有効性、品質の審査、医薬品の承認、既存医薬品の安全性監視、規制指導を行う組織です。具体的な役割としては以下が挙げられます。
- 新薬の承認:CDERは、新しい医薬品が市場に投入される前に、その安全性と有効性を評価し、承認を与えます。これには臨床試験のデータ分析や薬品の化学的特性の評価が含まれます。
- 既存医薬品の監視:市場に出回っている医薬品の安全性の監視を行います。副作用の報告を受け付け、その情報を元に適切な行動を取ることで、医薬品の安全性を確保します。
- 規制指導:医薬品の製造プロセスやラベル表示など、規制に関するガイドラインの策定や実施を行います。また、新しい技術や科学的知見に基づいて、医薬品の規制をアップデートする役割も担います。
- ジェネリック医薬品の承認:CDERは、オリジナルの医薬品の特許が切れた後、ジェネリック医薬品の承認を行います。これにより、医療費の削減や患者へのアクセス向上を目指します。
- コンプライアンス監督:医薬品のGMP査察を行います。
なお、CDERの下位組織やオフィスには、以下のような役割があります。
- Office of New Drugs(OND、新薬担当局):
- 新しい医薬品の承認に関する決定を行う。
- 臨床試験データの審査を行い、新薬の安全性と有効性を評価する。
- 一般的な医薬品審査業務を担当する。
- Office of Generic Drugs(OGD、後発医薬品担当局):
- 後発医薬品(ジェネリック医薬品)の承認に関する決定を行う。
- 原薬と同等の品質、安全性、有効性を持つ後発医薬品の審査を行う。
- Office of Compliance(OC、コンプライアンス担当局):
- 医薬品製造施設のGMPに対する査察を実施し、コンプライアンスを監視する。
- 医薬品の市場流通における違法・不適切な活動を監視し、対処する。
- Office of Pharmaceutical Quality(OPQ、医薬品品質担当局):
- 医薬品の品質に関する業務を統括し、製品の品質保証と品質管理を担当する。
- 医薬品製造プロセスや品質管理システムに関する指導を行う。
- Office of Translational Sciences(OTS、翻訳科学担当局):
- 医薬品開発の早期段階における科学的な課題や革新的なアプローチに焦点を当てる。
- 臨床試験デザインや生物学的指標の開発に関する研究・開発を行う。
2024年3月時点のCDER組織図は以下のとおりです。最新版はFDAホームページからご確認いただけます。

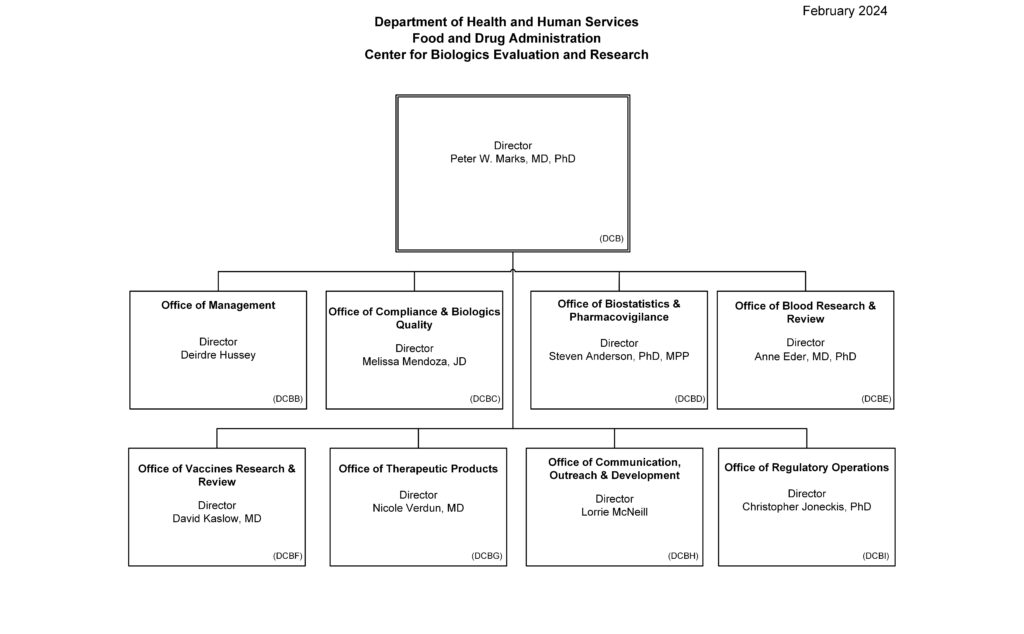
CBER(Center for Biologics Evaluation and Research)
CBERとはCenter for Biologics Evaluation and Researchの略称で、生物医薬品の安全性、有効性、品質の審査、医薬品の承認、既存生物医薬品の安全性監視、規制指導を行う組織です。具体的な役割としては以下が挙げられます。
- 生物医薬品の安全性と有効性の審査:CBERは、生物医薬品(ワクチン、血液製剤、細胞療法など)の承認に向けて、臨床試験データや研究結果を評価します。生物医薬品が患者に安全であり、効果的であることを確認します。
- 血液製剤の規制:CBERは、輸血用の血液製剤や血液製剤の製造・使用に関する規制を行います。これには、安全な輸血とその他の治療に必要な血液製剤の確保が含まれます。
- ワクチンの審査と安全性モニタリング:CBERは、新しいワクチンの承認審査を行います。また、市販後のワクチンの安全性をモニタリングし、副作用や安全性に関する報告を評価します。
- 細胞療法と遺伝子療法の規制:CBERは、細胞療法や遺伝子療法などの新しい治療法の承認審査と規制を行います。これらの治療法が患者にとって安全で有効であることを確認します。
- コンプライアンス監督:生物医薬品のGMP査察を行います。
なお、CDERの下位組織やオフィスには、以下のような役割があります。
- Office of Vaccines Research and Review(OVRR、ワクチン研究審査局):
- 新しいワクチンの承認に関する決定を行う。
- ワクチンの臨床試験データを審査し、安全性と有効性を評価する。
- ワクチンの製造施設に対するGMP(Good Manufacturing Practice)査察を実施する。
- Office of Blood Research and Review(OBRR、血液研究審査局):
- 輸血用の血液製剤や血液関連製品の承認に関する決定を行う。
- 血液製剤の安全性と有効性を評価し、新しい製品の審査を行う。
- 血液製剤製造施設のGMP査察を実施する。
- Office of Therapies Products(OTP、先進療法担当局):
- 細胞療法や遺伝子療法などの先進的な治療法に関する承認審査を行う。
- 細胞、組織、および細胞・組織由来の製品の安全性と有効性を評価する。
- 先進的な治療法製造施設のGMP査察を実施する。
- Office of Communication, Outreach and Development(OCOD、情報伝達、広報、および開発担当局):
- CBERの情報を一般市民や医療専門家に提供する。
- 重要な安全情報やアップデートを広報し、公衆の健康に関する教育活動を行う。
- Office of Compliance and Biologics Quality(OCBQ、コンプライアンスおよび生物医薬品品質担当局):
- 生物医薬品製造施設のGMPに対する査察を実施し、コンプライアンスを監視する。
- 生物医薬品の市場流通における違法・不適切な活動を監視し、対処する。
- 生物医薬品の品質管理と品質保証に関する業務を担当する。
2024年3月時点のCDER組織図は以下のとおりです。最新版はFDAホームページからご確認いただけます。
また、CBERの役割・責任範囲はFAQが公開されておりとても参考になります。こちらのFDAホームページからご確認いただけます。